
peso molecular Pb(NO3)2 Brainly.lat
Enter an equation of a redox chemical reaction and press the Balance button. The balanced equation will be calculated along with the oxidation states of each element and the oxidizing and reduction agents. Use uppercase for the first character in the element and lowercase for the second character. Examples: Fe, Au, Co, Br, C, O, N, F.

Ejercicios Ajustar Reacciones 2 Eso Pdf
2SO 2 + O 2 → 2SO 3. Esto nos da dos átomos de S en ambos lados y un total de seis átomos de O en ambos lados de la ecuación química. Esta reacción redox ahora está equilibrada. Ejercicio 14.3.1 14.3. 1. Equilibrar esta reacción redox mediante inspección: Al + O 2 → Al 2 O 3.

Is Pb(NO3)2 acidic, basic, or neutral (dissolved in water)? YouTube
PbS + HNO3 = Pb(NO3)2 + NO + S + H2O; Sn + HNO3 = SnO2 + NO2 + H2O; Zn(s) + HNO3(aq) = Zn(NO3)2(aq) + NH4NO3(aq) + H2O(l). N2H4 + Cu(OH)2 = N2 + Cu. Ajustar las siguientes reacciones redox por el método ión-electrón.. medio ácido 1. KI + KNO2 + H2SO4 = I2 + NO + K2SO4 + H2O. Ajusta por el método del ion-electrón las reacciones en.

Ejercicios De Ajustar Reacciones Quimicas 3 ESO PDF 2024
Ajusta la reacción química: H2 + O2 H2O 7. Ajusta la reacción química: H2SO4 + Al Al2 (SO4)3 + H2 (g) 8. Ajusta la reacción química: NaCl + H2SO4 Na2SO4 + HCl 9. Ajusta la reacción química: CaCO3 + HCl CaCl2+CO2+H2O Pasos a seguir: 1. Asigna una letra a cada coeficiente estequiométrico.

Para la siguiente reacción Pb (NO3)2 + 2 KI → PbI2 +2KNO3 ¿Qué masa de
Biblioteca en línea. Materiales de aprendizaje gratuitos. Ajuste de reacciones - Ejercicios resueltos Ajusta las siguientes reacciones químicas: a) H2 + O2 = H2O b) N2 + H2 = NH3 c) H2O + Na = NaOH + H2 d) KClO3 = KCl + O2 e) BaO2 + HCl = BaCl2 + H2O2 f) H2SO4 + NaCl = Na2SO4 + HCl g) FeS2 = Fe3S4 + S2 h) H2SO4 + C = H2O + SO2 + CO2 i) SO2 + O2 = SO3 j) HCl + MnO2 = MnCl2 + H2O + Cl2.

Ajustar Las Siguientes Reacciones Quimicas Estudiar
Dado que el número de los electrones librados en la reacción de la oxidación tiene que ser idéntico al número de electrones recibidos en la reacción de la reducción, multiplicaremos las dos ecuaciones por el factor que dará el multiplicador mínimo común. O: Pb+2S-2 + 2HNO 3 → S0 + Pb (NO 3) 2 + 2e - + 2 H +. | *3. R:

Como AJUSTAR reacciones REDOX. K2Cr2O7 + H2S. Ajuste de Reacciones
Vista previa parcial del texto. ¡Descarga Balanceo de ecuaciones redox con ejercicios resueltos y más Resúmenes en PDF de Química solo en Docsity! Ejercicios de reacciones redox con solución Ajustes redox 1) Ajustar la siguiente ecuación por el método del ión-electrón, detallando los pasos correspondientes: KMnO4 + K2SO3 + HCl ⇌ MnO2.

Zadovoljiti činjenica Napraviti večeru calculo de reacciones ejercicios
Estos procesos pareados se denominan reacciones de "reducción-oxidación", o "redox" para abreviar. Por lo que la reducción de Cu (I) a Cu (0) es solo una "media reacción"; necesita una oxidación correspondiente para que suceda. Li podría donar un electrón, por ejemplo, para convertirse en Li +.
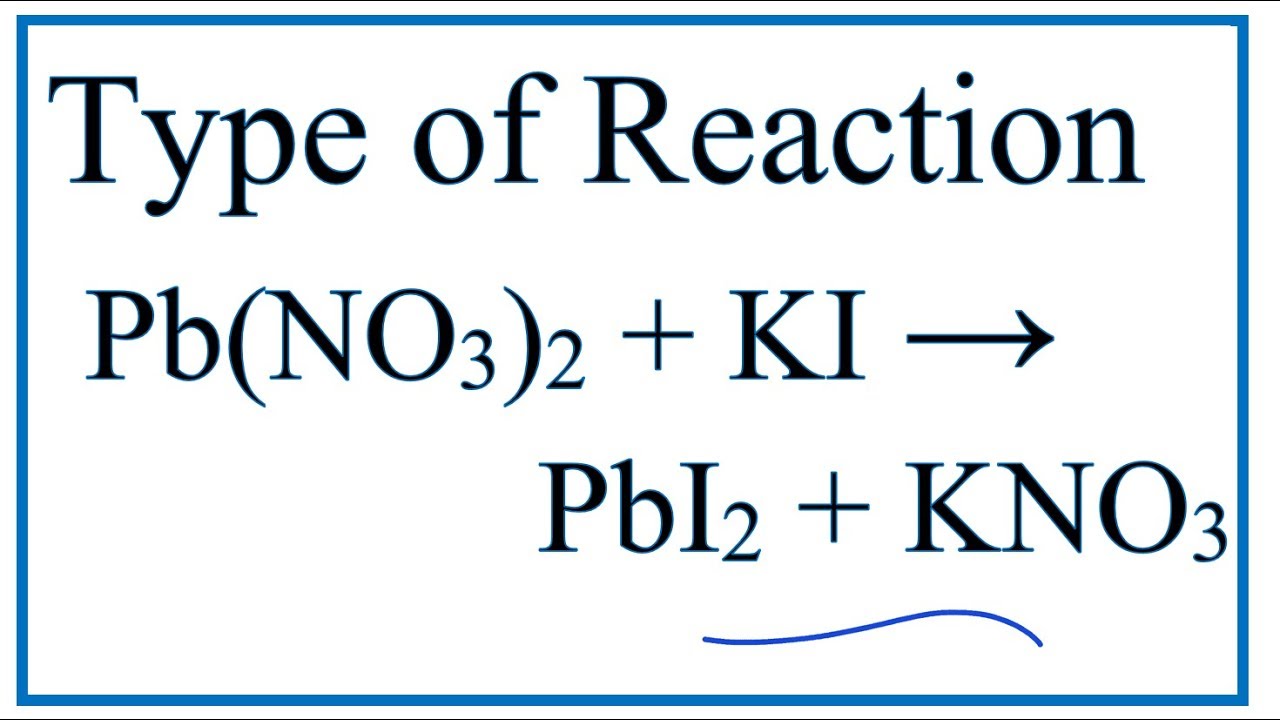
Type of Reaction for Pb(NO3)2 + KI = KNO3 + PbI2 YouTube
Ecuaciones Químicas online. Enviar. Búsqueda avanzada. O Prueba una reacción aleatoria. Una aplicación para balancear y completar ecuaciones de reacciones químicas. Soporta también los ecuaciones iónicas o redox.

Ajustar Las Siguientes Reacciones Quimicas Estudiar
Ejemplo 4.1.1 4.1. 1: balanceando ECUACIONES QUÍMICAS. Escriba una ecuación balanceada para la reacción de nitrógeno molecular (N 2) y oxígeno (O 2) para formar pentóxido de dinitrógeno. Solución. Primero, escriba la ecuación que no está balanceada. N2 +O2 → N2O5 (unbalanced) (unbalanced) N 2 + O 2 → N 2 O 5.

(DOC) Clasifique las siguientes reacciones como uno de los cinco tipos
Balancear las siguientes ecuaciones por metodo algebraico 1).- PbO2 + MnSO4 + HNO3 --> HMnO4 + Pb(NO3)2 + PbSO4 + H2O 2).- NaBiO3 + MnSO4 + HNO3 --> HMnO4 + Bi(NO3)3 + NaNO3 + Na2SO4 + H2O. Reacción química de descomposición definición Las reacciones químicas de descomposición son aquellas en las que una sustancia única se esc.

Ayudaa por favor! no se como resolver este ejercicio! Una solucion de
Deduzca los términos que faltan para representar los cambios de concentración en cada una de las siguientes reacciones. (a) C 2 H 2 (g). Cuando se deja reaccionar 1 mol de C 2 H 5 OH y CH 3 CO 2 H en 1 L del solvente dioxano, el equilibrio se establece cuando queda 1 3 1 3 mol de cada uno de los reactivos. Calcule la constante de.

Complete the missing components/variables given as x and y in the
Texto completo. (1) Ajustar las siguientes reacciones redox por el método del ión-electrón. 1. Cuando el ácido clorhídrico reacciona con dicromato potásico se obtiene cloro molecular, cloruro crómico, agua y cloruro potásico. Ajustar la ecuación iónica y la molecular correspondientes. Determinar el peso. equivalente del oxidante y el.
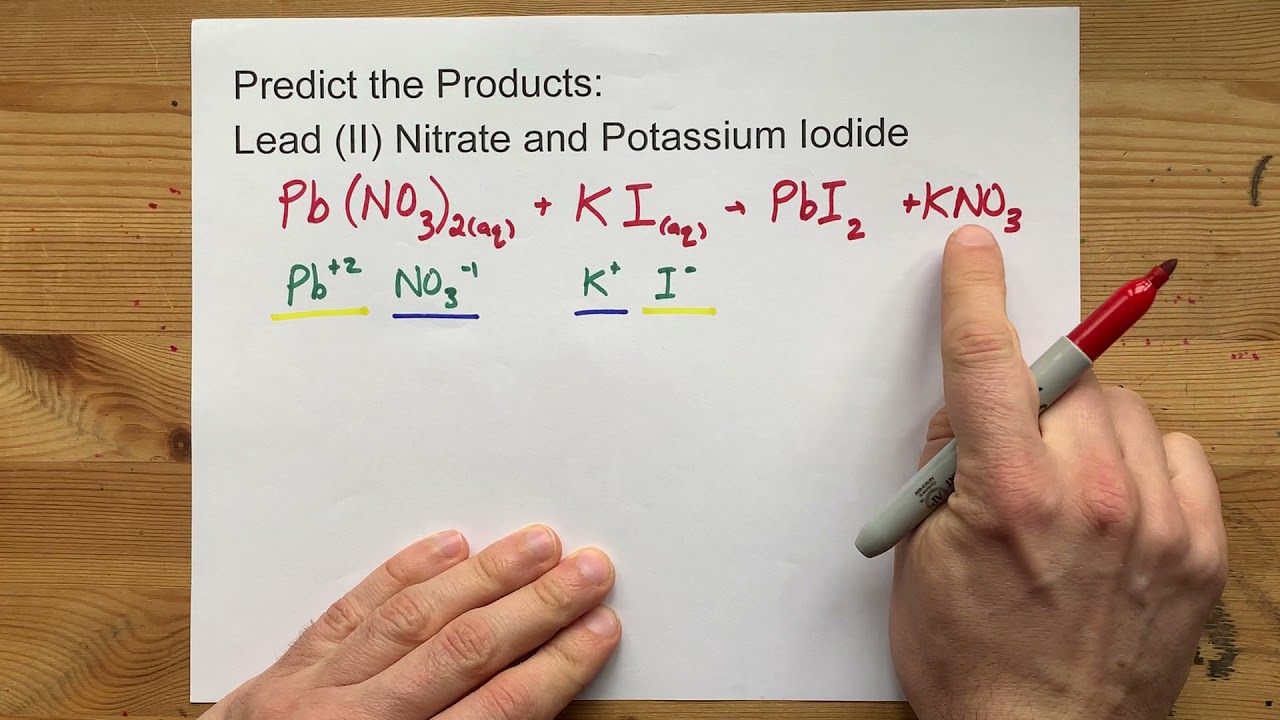
Predict the Products Pb(NO3)2 + KI Lead (II) Nitrate + Potassium
Instrucciones sobre equilibrio de ecuaciones químicas: Escribe una ecuación de una reacción química y pulsa el botón Ajustar. La respuesta aparecerá abajo. Utiliza siempre las mayúsculas para la primera letra del nombre del elemento y las minúsculas para el segundo caracter del mismo. Ejemplos: Fe {3 } I {-} = {Fe 2 } I2.

Álbumes 103+ Imagen Ejercicios De Fisica Y Quimica De 3 Eso Resueltos Lleno
Para balancear una ecuación química, ingresa la ecuación de una reacción química y pulsa el botón de Balancear. La ecuación balanceada aparecerá arriba. Utiliza mayúsculas para el primer carácter en el elemento y minúsculas para el segundo carácter. Ejemplos: Fe, Au, Co, Br, C, O, N, F. Las cargas iónicas aún no son soportadas y.

Ajuste e interpretación de ecuaciones químicas. Actividades
551.- El monóxido de nitrógeno se puede obtener según la siguiente reacción: Cu + HNO3 → Cu(NO3)2 + NO + H2O a) Ajuste por el método del ion-electrón esta reacción en sus formas iónica y molecular. b) Calcule la masa de cobre que se necesita para obtener 5 litros de NO medidos a 750 mm de Hg y 40 ºC. Datos: R = 0´082 atm·L·mol-1.
- 2013 Hyundai I30 Radio No Sound
- Hoteles Madrid Aeropuerto Barajas Transfer
- Acceso Laboral Fijo Junta De Andalucia
- Club De Lectura Madrid Chamberí
- Paris Football Club Verein Für Leibesübungen Wolfsburg Frauen
- Collar De Diamantes Y Agias Marinas
- Catalogo Primavera Verano 2017 Kookai
- El Manuscrito De Piedra Wikipedia
- Mazda Cx 3 Interior 2020
- Horarios Y Recorridos Semana Santa Sevilla 2022
